- Envoyer à un ami
-
-
facebook
-
google +
-
Version imprimable
-
Envoyer cette page par e-mail
Santé-UE - Lettre d'information
166 -
Coup de projecteur
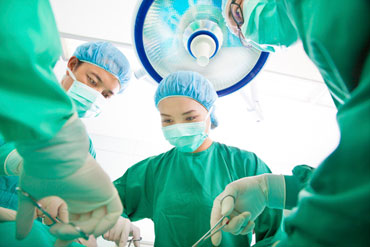
Dans quelle mesure l’utilisation de treillis chirurgicaux en chirurgie urogynécologique est-elle sûre?
Pr Christopher Chapple, docteur en médecine, secrétaire général de l’Association européenne d’urologie et rapporteur de l’avis du CSRSEN sur les treillis chirurgicaux

L’utilisation de plus en plus courante des treillis chirurgicaux en chirurgie urogynécologique va de pair avec une augmentation du nombre d’effets indésirables rapportés, tels que: infection, érosion des tissus, contact avec le treillis, rétrécissement des mailles, douleurs et dysfonctionnements sexuels. La Commission a donc demandé au Comité scientifique indépendant des risques sanitaires émergents et nouveaux (CSRSEN) d’évaluer les risques pour la santé liés à l’utilisation de treillis chirurgicaux.
Le CSRSEN s'est penché sur les différentes possibilités de traitement des dysfonctionnements du plancher pelvien en examinant la littérature scientifique récente sur le sujet et les lignes directrices des sociétés scientifiques et des autorités sanitaires, ainsi que les méthodes de traitement non chirurgicales et chirurgicales et les différents types de treillis. L'avis du CSRSEN porte sur les risques sanitaires des treillis utilisés en chirurgie urogynécologique, les moyens de déterminer les groupes de patients à haut risque et les besoins en matière d’évaluation.
Le CSRSEN a conclu que les résultats cliniques après l'implantation d'un treillis dépendent de toute une série de facteurs, parmi lesquels les propriétés des matériaux, la conception du produit, la taille globale du treillis, la voie d’implantation, les caractéristiques des patients, les procédures associées (hystérectomie, par exemple) et l'expérience du chirurgien — autant d’éléments qui devraient être pris en considération dans le choix d’un traitement approprié.
Pour évaluer les risques sanitaires liés aux treillis synthétiques, il convient d'établir une distinction claire entre les risques mineurs associés à la mise en place de bandelettes sous-urétrales en cas d'incontinence urinaire d’effort (IUE) et ceux liés à l'utilisation de treillis chirurgicaux après un prolapsus des organes pelviens (POP).
Dans ses conclusions, le CSRSEN se montre favorable à la poursuite de l’utilisation de bandelettes synthétiques lors d'interventions chirurgicales pour IUE, étant donné qu’il s’agit d’une procédure acceptée ayant fait la preuve de son efficacité et de son innocuité chez la majorité des patients souffrant d'IUE modérée à forte, à condition que les chirurgiens qui la pratiquent soient expérimentés et dûment qualifiés.
Le CSRSEN n’est toutefois pas favorable à l’utilisation de treillis synthétique lors d'interventions transvaginales destinées à réparer un prolapsus des organes pelviens. En raison des risques accrus associés à ce type d’opération, ces treillis ne devraient être utilisés que lorsque d’autres procédures chirurgicales ont échoué ou sont vouées à l’échec.
L'évaluation des risques rapportés indique que les treillis en polypropylène de type 1 sont les treillis synthétiques les plus appropriés à une utilisation vaginale et que les treillis en polypropylène de type 1 et ceux en polyester de type 3 sont les plus appropriés à l’insertion par voie abdominale.
Compte tenu de la nature des interventions pratiquées, il est absolument indispensable de bien sélectionner et conseiller les patients pour obtenir les meilleurs résultats possibles.
Le CSRSEN recommande de limiter, dans la mesure du possible, la quantité de treillis pour toutes les procédures et d’introduire un système de certification des chirurgiens sur la base de lignes directrices internationales en vigueur et en coopération avec les associations chirurgicales européennes concernées.
Pour consulter l’intégralité de l’évaluation et en savoir plus sur l’utilisation de treillis chirurgicaux en chirurgie urogynécologique, veuillez vous référer à l’avis final, publié en décembre 2015, à la suite d’une consultation publique sur l’avis préliminaire. Une fiche d’information donne également un aperçu clair du sujet.
http://ec.europa.eu/dgs/health_food-safety/dyna/enews/enews.cfm?al_id=1656
Troisième avis final sur la biologie de synthèse: risques pour l’environnement et la biodiversité et priorités en matière de recherche
En décembre 2015, la Commission européenne et ses comités scientifiques non alimentaires ont publié leur troisième avis final concernant la biologie de synthèse, et plus particulièrement les risques pour l’environnement et la biodiversité liés à la biologie de synthèse et les priorités en matière de recherche dans ce domaine. Il s'agit du troisième et dernier avis scientifique en matière de biologie de synthèse.
Le premier avis a mis l’accent sur la portée et la définition de la biologie de synthèse et sur ses différences et similitudes avec le génie génétique. Confirmant la réputation mondiale des comités scientifiques et l’excellence scientifique de leurs conseils, le groupe ad hoc d’experts techniques sur la biologie de synthèse des Nations unies a récemment adopté la définition de la biologie de synthèse proposée par les comités scientifiques, à savoir «l’application de la science, de la technologie et de l’ingénierie afin de faciliter et d’accélérer la conception, la fabrication et/ou la modification de matériel génétique dans les organismes vivants».
Le deuxième avis concernait les conséquences de l'évolution probable de la biologie de synthèse sur la santé humaine et animale et sur l'environnement, et visait à déterminer si les pratiques européennes d'évaluation des risques sanitaires et environnementaux actuellement appliquées aux organismes génétiquement modifiés sont adaptées à la biologie de synthèse. Les comités scientifiques ont en outre été invités à présenter des propositions de modification des méthodes d’évaluation des risques et des procédures d’atténuation des risques, y compris des dispositifs de verrouillage.
Le troisième avis, qui vient d'être publié, constate de graves lacunes dans les connaissances devant être prises en considération pour réaliser une évaluation des risques fiable et formule des recommandations en matière de recherche fondées sur les lacunes constatées.
Les comités scientifiques ont limité la portée de leur analyse à un avenir prévisible, reconnaissant que leurs conclusions devraient être réexaminées et actualisées dans quelques années, en fonction de l’évolution des technologies de la biologie de synthèse.
Autre actualité liée: un atelier consacré à la biologie de synthèse a été organisé par la Commission européenne sous les auspices de la présidence luxembourgeoise, le 10 décembre 2015, à l’université du Luxembourg, à Belval. Cet atelier, qui a réuni des scientifiques, des spécialistes de l’évaluation des risques, des gestionnaires de risques, des décideurs politiques et des universitaires, a été l’occasion pour la Commission européenne de présenter ses avis sur la biologie de synthèse et d'aborder ses autres activités dans ce domaine. Il a également permis à tous les participants d'examiner la biologie de synthèse selon différentes perspectives et de partager leurs points de vue et leurs expériences.
http://ec.europa.eu/dgs/health_food-safety/dyna/enews/enews.cfm?al_id=1655
Révision des «Notes d’orientation du CSSC relatives aux essais d’ingrédients cosmétiques et à l’évaluation de leur sécurité»
Les «notes d’orientation» rédigées par les membres du Comité scientifique pour la sécurité des consommateurs (CSSC) contiennent des informations sur les différents aspects de l’expérimentation et de l'évaluation de la sécurité des produits cosmétiques en Europe. Elles portent essentiellement sur les ingrédients des produits cosmétiques, mais donnent également quelques indications sur l’évaluation de la sécurité des produits finis. Ces notes visent en outre à aider les pouvoirs publics et l’industrie des produits cosmétiques à se conformer à la législation sur les cosmétiques en vigueur dans l’UE. Bien que concernant principalement les ingrédients et non les produits finis, elles peuvent être utiles pour établir le dossier d’information d'un produit cosmétique fini, qu'impose actuellement la législation européenne.
Les notes d’orientation sont régulièrement mises à jour. Cette dernière mise à jour s'explique par le fait que de nouveaux addenda, avis et notes importants pour le contenu des notes d’orientation ont été adoptés depuis la révision précédente, en 2012. En outre, depuis 2013, la législation européenne sur les cosmétiques a été modifiée: elle interdit désormais la commercialisation de produits finis contenant des ingrédients ou des combinaisons d’ingrédients qui ont été soumis à des essais sur les animaux après 2013.
Le règlement relatif aux cosmétiques prévoit qu’un produit cosmétique mis sur le marché doit être sûr pour la santé humaine lorsqu’il est utilisé dans des conditions normales ou raisonnablement prévisibles. Dans la pratique, les produits cosmétiques ont rarement été associés à de graves dangers pour la santé, mais cela ne signifie pas que leur utilisation soit sans danger. Il convient d'accorder une attention particulière à la sécurité à long terme, car ces produits peuvent être utilisés tout au long de la vie.
Pour les substances telles que les colorants, conservateurs et filtres ultraviolets, qui suscitent plus particulièrement l'inquiétude, une évaluation de la sécurité est effectuée au niveau de la Commission par le CSSC, qui examine toutes les données scientifiques disponibles, ainsi que les données cliniques, études épidémiologiques, données d’accidents et autres données humaines appropriées.
Lors de la mise à jour de 2015 (neuvième révision du document), le CSSC a accordé une attention particulière aux méthodes de substitution à l'expérimentation animale pouvant convenir aux essais de sécurité des produits cosmétiques. Parmi les autres grands changements introduits par le nouveau règlement sur les cosmétiques et pris en considération dans cette révision figurent les exigences de sécurité accrues pour les produits cosmétiques, l’introduction de la notion de «personne responsable», la notification centralisée de tous les produits cosmétiques mis sur le marché de l’UE, l’introduction de l'obligation de notifier les effets indésirables graves (EIG), de nouvelles règles concernant l’utilisation de nanomatériaux dans les produits cosmétiques, et l’introduction d’un ensemble d’exigences en matière de substances cancérigènes, mutagènes et tératogènes (CMR).
Les «notes d’orientation» ne constituent pas une liste de contrôle, mais sont destinées à être utilisées dans le cadre d’une approche au cas par cas. En effet, le CSSC insiste sur le fait que l’évaluation de la sécurité des substances cosmétiques et des produits finis ne peut se faire qu'au cas par cas.
http://ec.europa.eu/health/scientific_committees/consumer_safety/docs/sccs_o_190.pdf
Avis préliminaire sur l'estimation de la quantité de matière de jouet ingérée par les enfants
Le Comité scientifique des risques sanitaires et environnementaux (CSRSE) a été invité à réexaminer les données disponibles sur l’ingestion de trois types de matières de jouet par les enfants, afin d’évaluer si les limites de migration actuelles étaient encore appropriées. La question était de savoir si les limites d’ingestion quotidienne de 100 mg, pour la matière de jouet sèche, friable, poudreuse ou souple, et de 400 mg, pour la matière de jouet liquide ou collante, devaient être converties en limites hebdomadaires.
Le CSRSE a étudié la littérature publiée depuis 2008 et formulé un avis préliminaire, dans lequel il estime que les valeurs limites de migration actuelles sont appropriées et que toutes les limites d’ingestion devraient rester quotidiennes et non hebdomadaires.
Cet avis préliminaire, à présent disponible en ligne, fait l’objet d’une consultation publique jusqu’au 14 février 2016.
http://ec.europa.eu/dgs/health_food-safety/dyna/enews/enews.cfm?al_id=1657