- Empfehlen
-
-
facebook
-
google +
-
Druckfassung
-
Versenden
Newsletter von Health-EU
166 -
Brennpunkt
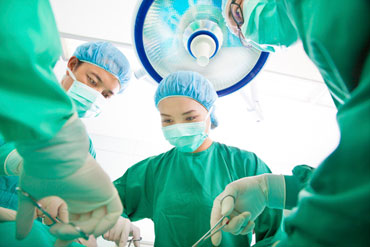
Wie sicher ist die Verwendung chirurgischer Netze in der urogynäkologischen Chirurgie?
von Professor Dr. Christopher Chapple, MD, Generalsekretär des Europäischen Urologenverbands und Berichterstatter für die Stellungnahme des SCENIHR zu chirurgischen Netzen

Mit der zunehmenden Verwendung chirurgischer Netze in der urogynäkologischen Chirurgie kommt es auch immer häufiger zu Komplikationen wie Verengung oder Freilegung des Netzmaterials, Gewebeläsionen und Infektionen sowie Nebenwirkungen wie Schmerzen und sexuelle Funktionsstörungen. Deshalb hat die Europäische Kommission den Wissenschaftlichen Ausschuss „Neu auftretende und neu identifizierte Gesundheitsrisiken“ (SCENIHR) beauftragt, die Gesundheitsgefährdungen zu analysieren, die von chirurgischen Netzen ausgehen.
Der SCENIHR prüfte anhand der einschlägigen aktuellen Fachliteratur und der Leitlinien wissenschaftlicher Gesellschaften und Gesundheitsbehörden verschiedene Optionen für die Behandlung von Funktionsstörungen des Beckenbodens und untersuchte dabei sowohl chirurgische als auch nichtchirurgische Behandlungsmethoden sowie verschiedene Arten von Netzgewebe. Im Mittelpunkt der Stellungnahme des Ausschusses stehen die von mit der Verwendung chirurgischer Netze in der urogynäkologischen Chirurgie verbundenen Gesundheitsrisiken, die Ermittlung besonders gefährdeter Patientengruppen und der Analysebedarf.
Der SCENIHR gelangte zu der Schlussfolgerung, dass das klinische Ergebnis einer Netzimplantation von zahlreichen Faktoren abhängt, darunter die Materialeigenschaften, die Gestaltung und Größe des Netzes, der Implantationsweg, das Patientenprofil und begleitende Eingriffe (z. B. Hysterektomie) sowie die Erfahrung des Chirurgen; diese sind bei der Wahl einer geeigneten Therapie allesamt zu berücksichtigen.
Bei der Bewertung der von synthetischem Gewebe ausgehenden Gesundheitsrisiken müssen die mit der Schlingen-Operation (Implantation eines Stützbands bei Belastungsinkontinenz) verbundenen geringeren Risiken klar abgegrenzt werden von jenen einer Netzimplantation bei Beckenbodenvorfall.
Der SCENIHR unterstützt auf der Grundlage seiner Erkenntnisse bei mittlerer bis schwerer Belastungsinkontinenz weiterhin die Implantation synthetischer Bänder durch erfahrene und qualifizierte Chirurgen – ein anerkanntes Verfahren mit hoher Erfolgsrate.
Der SCENIHR befürwortet hingegen nicht nicht die vaginale Implantation synthetischer Gewebenetze zur operativen Behebung eines Beckenbodenvorfalls. Angesichts der erhöhten Risiken, die mit derartigen Eingriffen verbunden sind, sollten diese nur eingesetzt werden, wenn andere chirurgische Verfahren gescheitert sind oder keine Erfolgsaussichten haben.
Nach Analyse der ermittelten Risiken sind für die vaginale Implantation Typ-1-Polypropylennetze das am besten geeignete Synthetikgewebe; für die abdominale Implantation eignen sich Polypropylen Typ 1 und Polyester Typ 3.
Die sorgfältige Auswahl und Betreuung der Patientinnen ist bei allen chirurgischen Eingriffen von größter Bedeutung für das optimale Ergebnis, insbesondere aber bei Operationen dieser Art.
Der SCENIHR empfiehlt, die Menge des Netzgewebes bei allen Verfahren nach Möglichkeit zu begrenzen und ein auf bestehenden internationalen Leitlinien beruhendes und in Zusammenarbeit mit den einschlägigen europäischen Chirurgenverbänden konzipiertes Zertifizierungssystem für Ärzte einzuführen.
Eine umfassende Bewertung sowie weitere Einzelheiten zur Verwendung chirurgischer Netze in der urogynäkologischen Chirurgie finden sich in der endgültigen Stellungnahme, die im Dezember 2015 im Anschluss an eine öffentliche Konsultation zur vorläufigen Stellungnahme veröffentlicht wurde. Daneben ist ein Merkblatt mit einem leicht verständlichen Überblick über das Thema verfügbar.
http://ec.europa.eu/dgs/health_food-safety/dyna/enews/enews.cfm?al_id=1656
Abschließendes Gutachten – Synthetische Biologie III: Risiken für Umwelt und biologische Vielfalt sowie Forschungsprioritäten
Im Dezember 2015 haben die Europäische Kommission und ihre Wissenschaftlichen Ausschüsse für Non-Food-Erzeugnisse ihre abschließende Stellungnahme zum Thema „Synthetische Biologie“ (III) vorgelegt: Risiken der synthetischen Biologie für Umwelt und biologische Vielfalt und einschlägige Forschungsprioritäten. Dabei handelt es sich um das letzte von drei wissenschaftlichen Gutachten zur synthetischen Biologie (SynBio).
Die erste Stellungnahme beschäftigte sich schwerpunktmäßig mit der Tragweite und Definition der synthetischen Biologie sowie mit der Frage nach Gemeinsamkeiten mit der Gentechnik und Unterschieden dazu. Die von den Vereinten Nationen eingesetzte Ad-hoc-Arbeitsgruppe technischer Experten für synthetische Biologie hat vor Kurzem das weltweite Ansehen der Wissenschaftlichen Ausschüsse und die wissenschaftliche Exzellenz ihrer Empfehlungen bekräftigt und folgende Definition erstellt: „Synthetische Biologie ist die Anwendung von Wissenschaft, Technologie und Ingenieurtechnik, um Konstruktion, Herstellung und/oder Änderung genetischen Materials in lebenden Organismen zu vereinfachen und zu beschleunigen.“
Die zweite Stellungnahme konzentriert sich auf die Auswirkungen der voraussichtlichen Entwicklungen in der synthetischen Biologie auf Menschen, Tiere und die Umwelt wie auch die Frage, ob die Bewertungsmethoden der EU für genetisch veränderte Organismen für die synthetische Biologie geeignet sind. Die Wissenschaftlichen Ausschüsse wurden außerdem beauftragt, Vorschläge für die überarbeiteten Risikobewertungsmethoden und die Risikominderungsverfahren vorzulegen, so zum Beispiel hinsichtlich der Sicherheitsvorkehrungen und -einrichtungen.
Die kürzlich veröffentlichte dritte Stellungnahme verweist auf erhebliche Lücken in der Wissensbasis, die zur Erstellung einer zuverlässigen Risikobewertung geschlossen werden müssten, und gibt Empfehlungen für entsprechende Forschungsarbeiten.
Die Wissenschaftlichen Ausschüsse beschränkten ihre Analyse auf die absehbare Zukunft und räumten dabei ein, dass ihre Feststellungen in einigen Jahren im Lichte der weiteren Entwicklungen in der SynBiologie-Technologie überprüft und aktualisiert werden sollten.
Daneben organisierte die Europäische Kommission unter der Schirmherrschaft des luxemburgischen Ratsvorsitzes am 10. Dezember 2015 an der Universität Luxemburg in Belval einen Workshop über synthetische Biologie. Die Veranstaltung, an der Forscher und Wissenschaftler, Fachleute für Risikobewertung und Risikomanagement sowie politische Entscheidungsträger teilnahmen, war für die Kommission ein Forum zur Vorstellung ihres Gutachtens zur synthetischen Biologie und zur Erörterung ihrer anderen Maßnahmen auf diesem Gebiet, bot aber auch sämtlichen Teilnehmerinnen und Teilnehmern die Gelegenheit, synthetische Biologie aus verschiedenen Blickwinkeln zu betrachten und ihre Ansichten und Erfahrungen auszutauschen.
http://ec.europa.eu/dgs/health_food-safety/dyna/enews/enews.cfm?al_id=1655
Überarbeitete Leitlinien des SCCS für die Prüfung und Sicherheitsbewertung kosmetischer Bestandteile
Beim Leitfaden handelt es sich um ein von den Mitgliedern des Wissenschaftlichen Ausschusses „Verbrauchersicherheit“ (SCCS) erstelltes Dokument mit Informationen über die verschiedenen Aspekte der Prüfung und Sicherheitsbewertung kosmetischer Stoffe in Europa. Der Schwerpunkt liegt auf kosmetischen Bestandteilen, die Hinweise und Vorgaben betreffen aber auch die Sicherheitsbewertung von Fertigerzeugnissen und sollen der Kosmetikindustrie und den Behörden die Einhaltung und Anwendung der geltenden EU-Rechtsvorschriften im Kosmetikbereich erleichtern. Obwohl der Leitfaden eher Bestandteile als Fertigerzeugnisse behandelt, kann er bei der Erstellung der im EU-Recht derzeit vorgesehenen Produktinformationsdatei für ein kosmetisches Fertigerzeugnis nützlich sein.
Der Leitfaden wird regelmäßig aktualisiert. Seit der letzten Überarbeitung im Jahr 2012 wurde der Leitfaden um wichtige Nachträge, Gutachten und Memoranden erweitert, die Anlass für diese neuste Aktualisierung waren. Außerdem wurden die EU-Rechtsvorschriften im Kosmetikbereich seit 2013 geändert und verbieten jetzt das Inverkehrbringen von kosmetischen Mitteln, deren Bestandteile einzeln oder kombiniert in Tierversuchen erprobt wurden.
Nach der Kosmetikverordnung müssen die auf dem Markt bereitgestellten kosmetischen Mittel bei normaler oder vernünftigerweise vorhersehbarer Verwendung für die menschliche Gesundheit sicher sein. Kosmetische Erzeugnisse sind in der Praxis nur selten mit schweren gesundheitlichen Gefahren behaftet, was allerdings nicht bedeutet, dass ihre Verwendung stets ungefährlich ist. Besonderes Augenmerk erfordert die langfristige Sicherheit, da kosmetische Mittel häufig über große Zeiträume verwendet werden.
Für Zusätze wie Farb- und Konservierungsstoffe oder UV-Filter, die besonderer Beachtung bedürfen, erfolgt die Sicherheitsbewertung auf Ebene der Kommission durch den SCCS mittels Prüfung aller verfügbaren wissenschaftlichen und relevanten klinischen Daten, epidemiologischen Studien, aus Unfällen gewonnenen Informationen und sonstigen geeigneten Humandaten.
Bei der letztjährigen Aktualisierung – der neunten Überarbeitung des Dokuments – richtete der SCCS besonderes Augenmerk auf die bei Sicherheitsprüfungen der Bestandteile kosmetischer Mittel bestehenden Alternativen zu Tierversuchen. Zu den anderen wichtigen Änderungen im Zuge der neuen Kosmetikverordnung, die sich in dieser Aktualisierung niederschlagen, gehören die strengeren Sicherheitsanforderungen für Kosmetikprodukte, die Einführung des Begriffs der „verantwortlichen Person“, die zentralisierte Notifizierung aller auf dem EU-Markt in Verkehr gebrachten kosmetischen Mittel, die Einführung der Meldung „ernster unerwünschter Wirkungen“, neue Vorschriften für die Verwendung von Nanomaterialien in kosmetischen Mitteln sowie die Einführung von Anforderungen für KEF-Stoffe (krebserzeugende, erbgutverändernde und fortpflanzungsgefährdende Stoffe).
Der Leitfaden ist keine Checkliste, sondern soll im Zuge eines einzelfallbezogenen Ansatzes eingesetzt werden. So betont der Wissenschaftliche Ausschuss, dass die Sicherheitsbewertung von kosmetischen Stoffen und Fertigerzeugnissen nur von Fall zu Fall erfolgen kann.
http://ec.europa.eu/health/scientific_committees/consumer_safety/docs/sccs_o_190.pdf
Vorläufige Stellungnahme zu Schätzungen der Mengen der von Kindern aufgenommenen Spielzeugmaterialien
Um beurteilen zu können, ob die derzeitigen Migrationsgrenzwerte weiterhin angemessen sind, wurde der Wissenschaftliche Ausschuss „Gesundheits- und Umweltrisiken“ (SCHER) beauftragt, die verfügbaren Daten über die Aufnahme dreier Kategorien von Spielzeugmaterial durch Kinder zu prüfen. Es sollte geklärt werden, ob die Grenzwerte für die tägliche Aufnahme von 100 mg für trockenes, brüchiges, pulverförmiges oder geschmeidiges Spielzeugmaterial und von 400 mg für flüssiges oder haftendes Spielzeugmaterial in wöchentliche Grenzwerte geändert werden könnten.
Der SCHER überprüfte die seit 2008 veröffentlichte einschlägige Fachliteratur und erstellte daraufhin seine vorläufige Stellungnahme, worin er die Auffassung vertritt, dass die derzeit geltenden Migrationsgrenzwerte angemessen sind und dass alle Grenzwerte für die Aufnahme weiterhin als tägliche und nicht als wöchentliche Obergrenzen gelten sollten.
Die vorläufige Stellungnahme kann von der Öffentlichkeit nun online konsultiert und bis zum 14. Februar 2016 kommentiert werden.
http://ec.europa.eu/dgs/health_food-safety/dyna/enews/enews.cfm?al_id=1657